Experimentos de disolución de CaCO3 en foraminíferos bentónicos aglutinados del Paleoceno-Eoceno en Zumaya (Cuenca Vasco-Cantábrica, España)
CaCO3 dissolution experiments in Paleocene-Eocene agglutinated benthic foraminifera from Zumaya (Basque-Cantabric Basin, Spain)
G.J. Arreguín-Rodríguez1, L. Alegret1,2
1 Ciencias de la Tierra, Facultad de Ciencias, Universidad de Zaragoza, Calle Pedro Cerbuna 12 50009 Zaragoza (Spain). Email: gjarreguin@gmail.com
2 Instituto Universitario de Ciencias Ambientales de Aragón, IUCA, Universidad de Zaragoza, Calle Pedro Cerbuna 12 50009 Zaragoza (Spain).
| |
RESUMEN
Durante el evento de calentamiento global conocido como Máximo Térmico del Paleoceno-Eoceno (PETM por sus siglas en inglés;
hace ~55.8 Ma) tuvo lugar la mayor extinción de foraminíferos bentónicos de medios profundos de todo el Cenozoico. Mucho se
ha especulado sobre las causas de dicha extinción, que incluyen cambios en la productividad y/o en la oxigenación de las aguas,
cambios metabólicos y en la composición del aporte alimenticio al fondo marino, o la acidificación de los océanos relacionada
con el aporte masivo de isótopos de carbono ligero al sistema océano-atmósfera, entre otros.
En el presente estudio se analiza el potencial de la acidificación como agente desencadenante de las extinciones. En el corte
de Zumaya (Cuenca Vasco-Cantábrica), el Eoceno inicial está marcado por un intervalo de 4 m con muy bajo contenido en CaCO3. Con el fin de analizar si la disolución del carbonato tuvo una incidencia directa sobre las extinciones del PETM, se han
realizado experimentos de disolución en diversas especies de foraminíferos bentónicos aglutinados procedentes de Zumaya. En
general, las especies aglutinadas que no desaparecen en el intervalo de máxima disolución en Zumaya son aquellas que fueron
poco o nada afectadas por los experimentos de disolución, pues no presentan partículas y/o cemento calcáreo. No obstante,
algunas especies que se extinguieron y/o desaparecieron localmente durante el Eoceno inicial, como Dorothia cylindracea, Spiroplectammina spectabilis y Haplophragmoides cf. walteri, resultaron ser resistentes a la disolución. Estos resultados sugieren que, además de la acidificación, debieron darse otros
factores que contribuyeron a la desestabilización de las asociaciones de foraminíferos bentónicos.
Palabras clave: extinción;
foraminíferos bentónicos;
Paleoceno-Eoceno;
calentamiento;
acidificación.
|
| |
ABSTRACT
The largest extinction of deep-sea benthic foraminifera in the Cenozoic occurred during the Paleocene-Eocene Thermal Maximum
event (PETM, ~55.8 Ma). Much has been speculated about the causes of such extinction, and proposed mechanisms include changes
in productivity and/or oxygenation of bottom waters, metabolic changes and in the composition of the food supply to the seafloor,
or the ocean acidification related to the massive input of isotopically light carbon into the ocean-atmosphere system, among
others.
Here we analyse ocean acidification as a potential triggering mechanism of the extinctions. The early Eocene at the Zumaya
section (Basque-Cantabrian Basin) is marked by a 4 m-thick interval with a very low CaCO3 content. In order to analyse whether CaCO3 dissolution had a direct effect on the extinctions across the PETM, we carried out dissolution experiments on various species
of agglutinated benthic foraminifera from Zumaya. In general, agglutinated species that do not disappear in the interval of
most intense dissolution at Zumaya were not -or only slightly- affected by our dissolution experiments, since they do not
have calcareous particles or cement. However, some species that went extinct or locally disappeared during the early Eocene,
such as Dorothia cylindracea, Spiroplectammina spectabilis and Haplophragmoides cf. walteri, are resistant to dissolution. These results suggest that, in addition to ocean acidification, other factors must have contributed
to the destabilization of benthic foraminiferal assemblages.
Keywords:
benthic foraminiferal extinction;
Paleocene-Eocene;
warming;
ocean acidification.
|
IntroducciónTOP
Durante el tránsito Paleoceno-Eoceno (hace ~55.8 millones de años; Charles et al., 2011) se registra un evento de intenso calentamiento global en el que la temperatura aumentó entre 5–9 °C en la superficie y 4–5
°C en los fondos oceánicos (Zachos et al., 2003; Thomas, 2007) en menos de diez mil años (Röhl et al., 2000). Este evento se conoce como el Máximo Térmico del Paleoceno-Eoceno (PETM, por sus siglas en inglés), y se caracterizó por
una excursión negativa de los isótopos de carbono de 2.5–6‰ en registros marinos y terrestres (Kennett & Stott, 1991; Koch et al., 1992; Zachos et al., 2001; Bowen et al., 2006). Coincide además con la somerización del nivel de compensación de calcita (CCD) y de la lisoclina, que causaron a su vez
la acidificación de los océanos y la disolución del CaCO3 en extensas áreas oceánicas (Zachos et al., 2005).
El PETM tuvo importantes consecuencias bióticas tanto en ambientes marinos como terrestres, incluyendo la rápida evolución
y migraciones del nanoplancton calcáreo (Bralower, 2002; Stoll, 2005; Agnini et al., 2007) y de foraminíferos planctónicos (Kelly et al., 1998), la proliferación global de dinoflagelados del género Apectodinium (Crouch et al., 2001), la diversificación de macroforaminíferos bentónicos de medios someros (Orue-Etxebarria et al., 2001; Pujalte et al., 2003), la migración de plantas terrestres (Wing et al., 2005) y la radiación de mamíferos (Koch et al., 1992). Además, se registra la mayor extinción de foraminíferos bentónicos de medios profundos de todo el Cenozoico, en la que
el 35–50% de las especies desaparecieron (Tjalsma & Lohman, 1983; Thomas, 2007; Alegret et al., 2009a). Muchas han sido las causas propuestas para explicar dicha extinción, incluyendo la baja oxigenación de las aguas del fondo,
el incremento en la corrosividad de las aguas al carbonato cálcico, cambios en la productividad, aumento de temperatura o
una combinación de estos factores (Thomas, 2007). No obstante, considerando que el evento de extinción fue global y que el hábitat de los foraminíferos bentónicos es el
mayor del planeta (los fondos oceánicos), la causa o causas de la extinción debieron ser globales, mientras que los cambios
en oxigenación, productividad y corrosividad de las aguas se registran en amplias áreas paleogeográficas, pero no globalmente.
A pesar de la existencia de áreas en las que el contenido en carbonato no disminuyó significativamente durante el PETM (Takeda
& Kaiho, 2007), o donde incluso aumentó la acumulación de carbonato (Gibbs et al., 2006; John et al., 2008), recientemente se ha propuesto que la acidificación oceánica pudo ser la causa más importante de las extinciones (Thomas, 2012), argumentando que las especies extintas poseían caparazones calcíticos, o aglutinados con cemento calcáreo. Según esta autora,
las extinciones afectaron principalmente a especies que presentaban un modo de vida epifaunal, mientras que las especies calcíticas
infaunales sufrieron menos estrés porque la disolución del carbonato del sedimento incrementó la saturación de calcita en
el agua intersticial. Estos argumentos sugieren que la acidificación oceánica representó un problema para el crecimiento de
las conchas de algunos foraminíferos bentónicos (en vida), causando así su extinción.
Por otro lado, la identificación de extinciones en regiones donde el contenido en carbonato no disminuyó significativamente
(Takeda & Kaiho, 2007) o incluso aumentó durante el PETM (Gibbs et al., 2006; John et al., 2008) fue uno de los factores que llevaron a Alegret et al. (2010) a sugerir que la acidificación oceánica no fue la única causa de las extinciones. Esta observación nos ha llevado también
a descartar, en el presente artículo, los procesos tafonómicos (acidificación intensa durante la etapa bioestratinómica o
durante la fosildiagénesis temprana) para explicar la presencia o ausencia de foraminíferos susceptibles a la disolución en
los niveles del PETM. Aunque los resultados de la disolución tafonómica fueran los mismos a nivel global (dado que las extinciones
son globales), esta opción no explicaría las extinciones en aquellas localidades donde el contenido en carbonato no disminuyó
drásticamente.
En el presente estudio se analiza el potencial de la acidificación oceánica (descenso del pH y de la concentración de iones
carbonato en los océanos) como agente causante de la extinción de foraminíferos bentónicos, partiendo del supuesto de que
la disolución afectó a los foraminíferos en vida y no que dicha disolución haya ocurrido tras el enterramiento de los mismos.
Con el fin de corroborar si los restos fósiles de las especies que desaparecieron durante el PETM son susceptibles a la disolución
o no, se han llevado a cabo experimentos de disolución en diversas especies de foraminíferos bentónicos aglutinados. Los experimentos
se han realizado a nivel de especie y no de género o superior porque existen evidencias de que la acidificación oceánica provoca
respuestas concretas a nivel de especie (Ries et al., 2009).
Materiales y métodosTOP
Para llevar a cabo los experimentos de disolución en especies aglutinadas, se utilizó material empleado por Alegret et al. (2009a) en su estudio sobre foraminíferos bentónicos del PETM de la sección de Zumaya (Cuenca Vasco-Cantábrica). Para la situación
geográfica y geológica de Zumaya, nos referimos a dicho artículo. Los sedimentos del Paleoceno superior consisten en una alternancia
de margas y calizas margosas con intercalaciones de turbiditas. Los 80 cm superiores corresponden a una unidad de calizas
hemipelágicas verdosas (debido a la presencia de glauconita), y sobre el límite Paleoceno/Eoceno se reconoce una unidad de
margas y arcillas rojas pobres en carbonato, sobre la que se sitúa una alternancia de calizas y margas (Alegret et al., 2009a). Partiendo de la distribución de las especies de foraminíferos bentónicos y del patrón de extinción mostrados en Alegret et al. (2009a), se seleccionaron 81 ejemplares de foraminíferos aglutinados, incluyendo especies que se extinguieron durante el PETM como
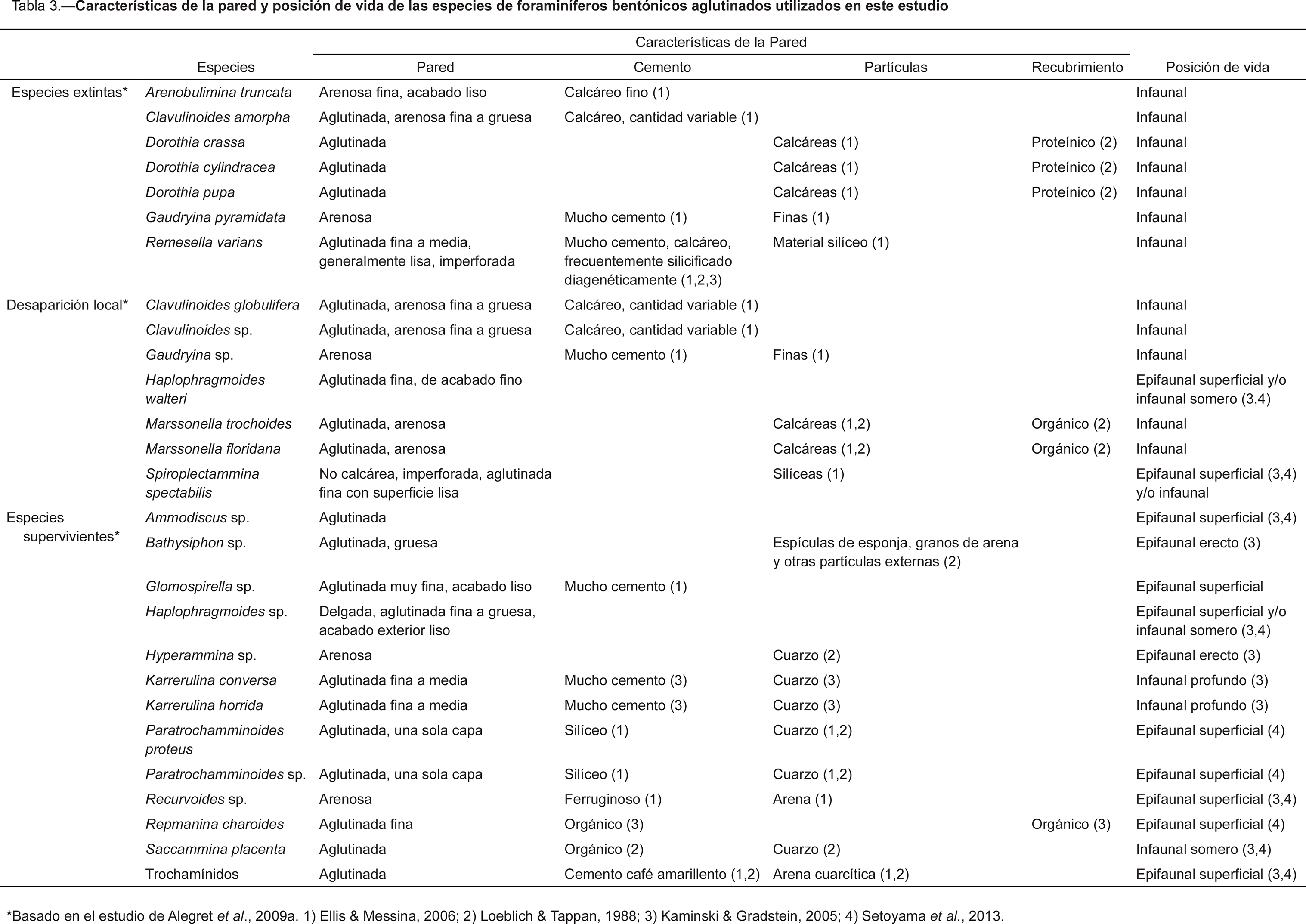
Arenobulimina truncata (Reuss) 1845, Clavulinoides amorpha (Cushman) 1926, Dorothia crassa (Marsson) 1878, Dorothia cylindracea Bermúdez 1963, Dorothia pupa (Reuss) 1860, Gaudryina pyramidata Cushman 1926, y Remesella varians (Glaessner) 1937, especies que desaparecieron localmente como Clavulinoides globulifera (Ten Dam & Sigal) 1950, Clavulinoides sp., Clavulinoides sp. juvenil, Gaudryina sp., Haplophragmoides cf. H. walteri (Grzybowski) 1898, Marssonella trochoides (Marsson) 1878, Marssonella floridana Applin & Jordan 1945, y Spiroplectammina spectabilis (Grzybowski) 1898, y especies que sobrevivieron o que incluso proliferaron durante el Eoceno inicial, como Ammodiscus sp., Bathysiphon sp., Glomospi-rella sp., Haplophragmoides sp., Hyperammina sp., Karrerulina conversa (Grzybowski) 1901, Karreru-lina horrida (Mjatliuk) 1970, Paratrochamminoides proteus (Karrer) 1866, Paratrochamminoides sp., Recurvoides sp., Repmanina charoides (Jones & Parker) 1860, Saccammina placenta (Grzybowski) 1898 y especies del grupo de los trochamínidos (Tabla 1, Fig. 1). En el caso de H. cf. walteri, se revisaron los ejemplares identificados por Alegret et al. (2009a) como H. walteri y se observó que los ejemplares de Zumaya poseen de 4 a 5 cámaras en vez de 8 a 9 cámaras (Kaminski & Gradstein, 2005). Por este motivo, se considera que tanto los ejemplares identificados en el artículo de Alegret et al. (2009a) como los empleados en el presente estudio corresponden a H. cf. walteri.
|
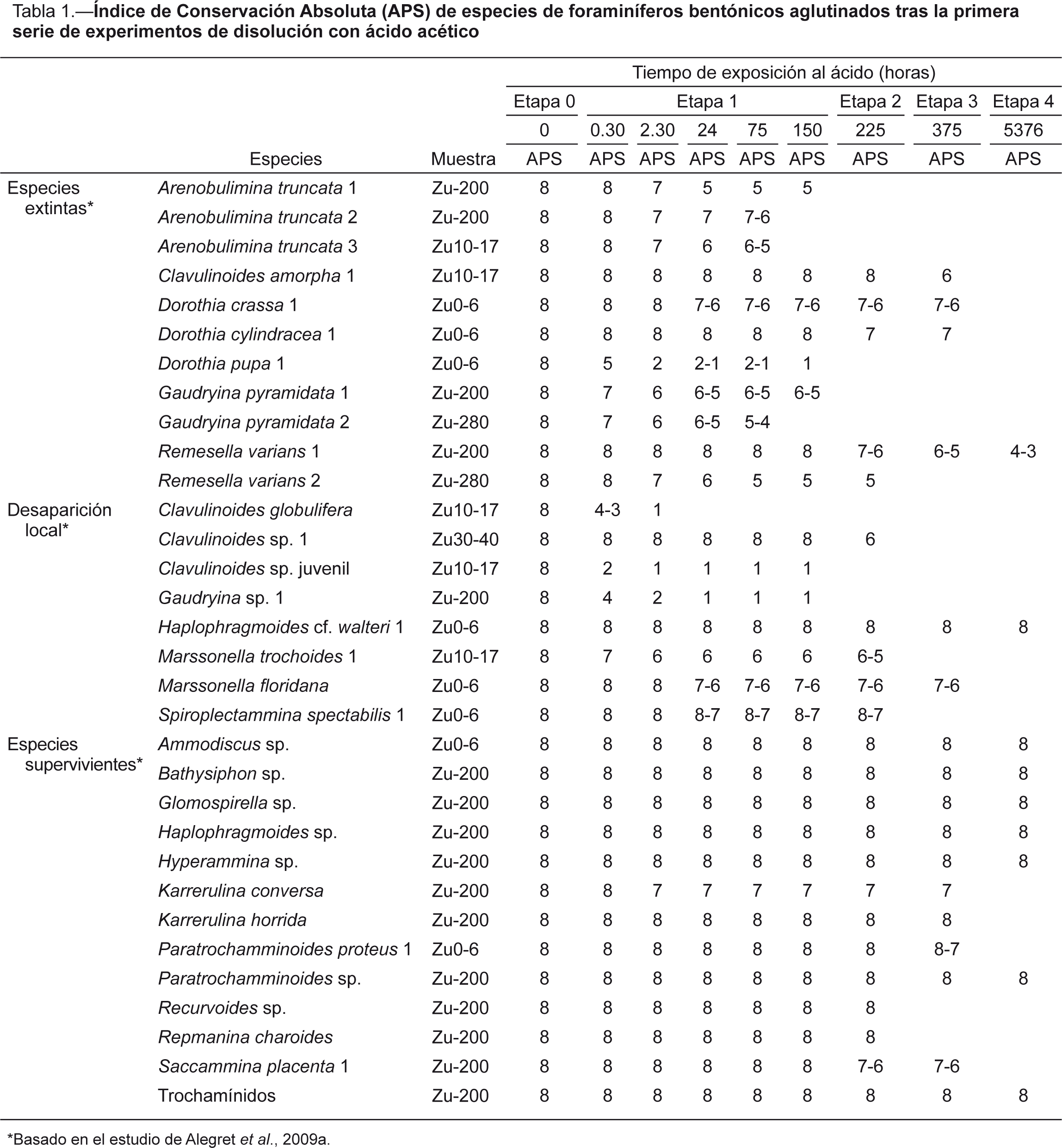
 Fig. 1.—Imágenes SEM de algunos ejemplares de foraminíferos bentónicos de Zumaya e índice APS alcanzado tras los experimentos de
disolución. Escala =100 μm. 1) Gaudryina pyramidata 2, vista frontal, muestra Zu -280, APS 4. 2) G. pyramidata 1, vista apertural, muestra Zu -200, APS 4. 3) Marssonella trochoides 1, vista apertural, muestra Zu 10-17, APS 5. 4) Arenobulimina truncata 3, vista frontal, muestra Zu 10-17, APS 6-5. 5) A. truncata 1, vista frontal, muestra Zu -200, APS 5. 6) Clavulinoides amorpha 1, vista frontal, muestra Zu 10-17, APS 6. 7) Clavulinoides sp. 1, vista frontal, muestra Zu 30-40, APS 6. 8) Remesella varians 2, vista frontal, muestra Zu -280, APS 6. 9) A. truncata 2, vista frontal, muestra Zu -200, APS 7-6. 10) Dorothia crassa 1, vista frontal, muestra Zu 0-6, APS 7-6. 11) M. floridana, vista frontal, muestra Zu 0-6, APS 7-6. 12) Karrerulina conversa, vista frontal, muestra Zu -200, APS 7. 13) D. cylindracea 1, vista frontal, muestra Zu 0-6, APS 7. 14) Paratrochamminoides proteus 1, vista frontal, muestra Zu 0-6, APS 7. 15) Saccammina placenta 1, vista frontal, muestra Zu -200, APS 7. 16) K. horrida, vista frontal, muestra Zu -200, APS 8. 17) Recurvoides sp., vista frontal, muestra Zu -200, APS 8. 18) Repmanina charoides, vista en sección, muestra Zu -200, APS 8. 19) Spiroplectammina spectabilis 1, vista frontal, muestra Zu 0-6, APS 8-7, el ejemplar se rompió durante la manipulación y no a causa de la disolución. 20)
Haplophragmoides cf. walteri, vista frontal, muestra Zu -50, APS 8. Fig. 1.—Imágenes SEM de algunos ejemplares de foraminíferos bentónicos de Zumaya e índice APS alcanzado tras los experimentos de
disolución. Escala =100 μm. 1) Gaudryina pyramidata 2, vista frontal, muestra Zu -280, APS 4. 2) G. pyramidata 1, vista apertural, muestra Zu -200, APS 4. 3) Marssonella trochoides 1, vista apertural, muestra Zu 10-17, APS 5. 4) Arenobulimina truncata 3, vista frontal, muestra Zu 10-17, APS 6-5. 5) A. truncata 1, vista frontal, muestra Zu -200, APS 5. 6) Clavulinoides amorpha 1, vista frontal, muestra Zu 10-17, APS 6. 7) Clavulinoides sp. 1, vista frontal, muestra Zu 30-40, APS 6. 8) Remesella varians 2, vista frontal, muestra Zu -280, APS 6. 9) A. truncata 2, vista frontal, muestra Zu -200, APS 7-6. 10) Dorothia crassa 1, vista frontal, muestra Zu 0-6, APS 7-6. 11) M. floridana, vista frontal, muestra Zu 0-6, APS 7-6. 12) Karrerulina conversa, vista frontal, muestra Zu -200, APS 7. 13) D. cylindracea 1, vista frontal, muestra Zu 0-6, APS 7. 14) Paratrochamminoides proteus 1, vista frontal, muestra Zu 0-6, APS 7. 15) Saccammina placenta 1, vista frontal, muestra Zu -200, APS 7. 16) K. horrida, vista frontal, muestra Zu -200, APS 8. 17) Recurvoides sp., vista frontal, muestra Zu -200, APS 8. 18) Repmanina charoides, vista en sección, muestra Zu -200, APS 8. 19) Spiroplectammina spectabilis 1, vista frontal, muestra Zu 0-6, APS 8-7, el ejemplar se rompió durante la manipulación y no a causa de la disolución. 20)
Haplophragmoides cf. walteri, vista frontal, muestra Zu -50, APS 8.
|
|
|
|
|
Para la disolución de los ejemplares se utilizó ácido acético (CH3COOH) de pH 3.5. Se ha estimado que el pH de las aguas oceánicas superficiales alcanzó valores de 7.85 durante el PETM (Hönish et al., 2012), sin embargo, dado que las condiciones ambientales (ej., presión de CO2 atmosférico) del Paleoceno-Eoceno fueron diferentes a las actuales, se desconoce la equivalencia de dicho pH en condiciones
actuales. Por esta razón, y dado que en el presente estudio únicamente se pretende averiguar si determinadas especies fueron
sensibles a la acidificación o no, los experimentos se han realizado con una solución muy ácida que permite reconocer fácilmente
aquellos ejemplares afectados por la disolución del carbonato. Los experimentos que analizan el comportamiento de los foraminíferos
bentónicos actuales en distintos escenarios de acidificación oceánica en condiciones controladas de laboratorio (ej., Fujita
et al., 2011; Reymond et al., 2013), persiguen mantener el pH estable a lo largo de todo el experimento (Hintz et al., 2004; McIntyre-Wressing et al., 2013). Sin embargo, en el presente estudio únicamente se pretende identificar si determinadas especies son afectadas o no por
la acidificación, por lo que no ha sido necesario mantener el pH constante a lo largo del tiempo.
Experimentos similares han tratado de comprobar la susceptibilidad a la disolución de foraminíferos planctónicos (Nguyen et al., 2011) y de foraminíferos bentónicos (Nguyen et al., 2009) en su mayoría calcíticos y de algunos aglutinados. Nguyen et al. (2009) señalan que la disolución puede estar condicionada por diferencias en el tamaño de la fracción estudiada, así como por la
estructura y grosor de la pared. Con el fin de evitar en la medida de lo posible estas incertidumbres, hemos basado nuestro
estudio en especies de foraminíferos bentónicos aglutinados adultos de la fracción >100 μm, con una única excepción en la
que se empleó un ejemplar juvenil para constatar su comportamiento ante la disolución. Para la primera serie de experimentos
se seleccionaron 32 ejemplares y se diferenciaron cuatro etapas (Tabla 1), partiendo de una etapa o fase inicial 0 en la que todos los ejemplares están intactos y bien conservados. En la primera
etapa, los ejemplares fueron expuestos a 2 ml de ácido acético durante 150 horas. Su estado de conservación fue corroborado
a las 0.5, 2.5, 24 y a las 150 horas usando un microscopio binocular y asignando un valor numérico basado en la escala de
conservación propuesta por Nguyen et al. (2009). Dicha escala consiste en 8 niveles según su índice de conservación absoluta (Absolute Preservation Score, APS), el cual varía de 8 (conchas intactas) a 1 (conchas completamente disueltas). En la segunda fase, los ejemplares que
no fueron completamente disueltos fueron nuevamente sometidos a exposición en 2 ml de ácido durante 75 horas más (sumando
un total de 225 horas), asignando un valor APS al final de la etapa. Posteriormente, los ejemplares que aún no presentaban
signos claros de ser afectados por la disolución fueron expuestos a 10 ml de ácido durante otras 150 horas (sumando un total
de 375 horas) y, de igual manera, en la cuarta etapa los ejemplares que no habían presentado susceptibilidad a la disolución
fueron sumergidos en 10 ml de ácido hasta completar 5376 horas desde el inicio del experimento.
Finalmente, para comprobar la validez y representatividad de los datos obtenidos en las disoluciones realizadas previamente,
se llevó a cabo una segunda serie de experimentos en la que se evaluó nuevamente la susceptibilidad de las especies que mostraron
alguna reacción al ácido (Fig. 2, Tabla 1). Para ello, se disolvieron otros 49 ejemplares, hasta completar un total de 5 ejemplares por cada especie (Fig. 3, Tabla 2), considerando los ejemplares disueltos previamente. En las especies D. cylindracea, D. pupa y C. amorpha no se completó el total de 5 ejemplares por falta de disponibilidad de los mismos, razón por la cual tampoco fue posible
disolver más ejemplares de M. floridana y C. globulifera. La disolución, en esta segunda serie de experimentos, se llevó a cabo con 2 ml de ácido acético por cada intervalo, y el
estado de conservación de las conchas se corroboró a las 12, 36, 60, 165, 180, 250 y 357 horas (Tabla 2).
|
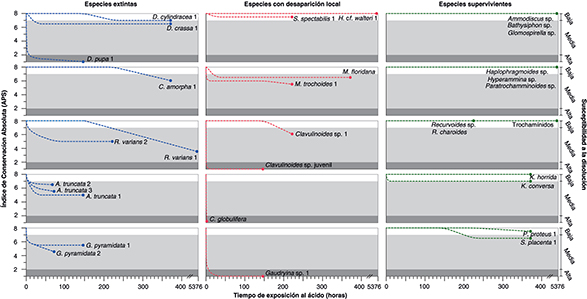 Fig. 2.—Índice de Conservación Absoluta (APS) con respecto al tiempo de exposición al ácido acético en la primera serie de experimentos.
En el eje Y a la derecha se marca el grado de susceptibilidad a la disolución según los valores APS (susceptibilidad alta
= APS 1-2, media = APS 2-7 y baja = APS 7-8). Fig. 2.—Índice de Conservación Absoluta (APS) con respecto al tiempo de exposición al ácido acético en la primera serie de experimentos.
En el eje Y a la derecha se marca el grado de susceptibilidad a la disolución según los valores APS (susceptibilidad alta
= APS 1-2, media = APS 2-7 y baja = APS 7-8).
|
|
|
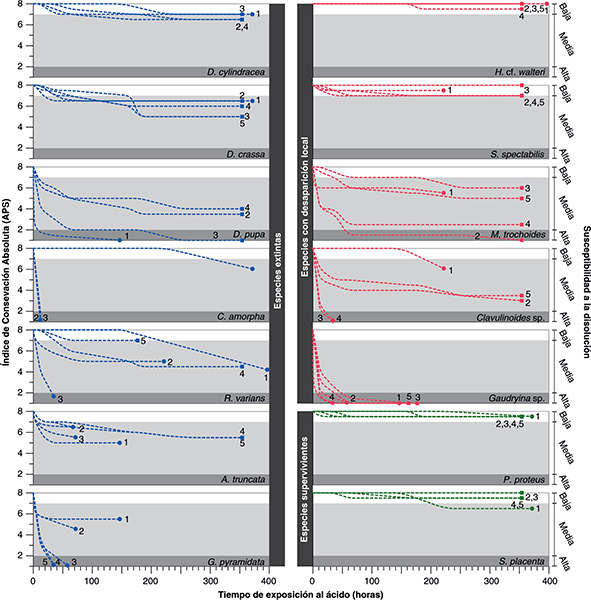 Fig. 3.—Índice de Conservación Absoluta (APS) con respecto al tiempo de exposición al ácido acético en la segunda serie de experimentos.
En el eje Y a la derecha se marca el grado de susceptibilidad a la disolución según los valores APS (susceptibilidad alta
= APS 1-2, media = APS 2-7 y baja = APS 7-8). En cada especie, los ejemplares marcados con círculos corresponden a los ejemplares
que fueron disueltos inicialmente mostrados en la Fig. 2, y los que están señalados con cuadrados indican a los ejemplares disueltos durante la segunda serie de experimentos. Fig. 3.—Índice de Conservación Absoluta (APS) con respecto al tiempo de exposición al ácido acético en la segunda serie de experimentos.
En el eje Y a la derecha se marca el grado de susceptibilidad a la disolución según los valores APS (susceptibilidad alta
= APS 1-2, media = APS 2-7 y baja = APS 7-8). En cada especie, los ejemplares marcados con círculos corresponden a los ejemplares
que fueron disueltos inicialmente mostrados en la Fig. 2, y los que están señalados con cuadrados indican a los ejemplares disueltos durante la segunda serie de experimentos.
|
|
ResultadosTOP
En la primera etapa de disolución, algunas especies reaccionaron casi inmediatamente al contacto con el ácido (Fig. 2), produciendo y liberando burbujas de dióxido de carbono gaseoso a diferentes velocidades (rápida-media: Clavulinoides sp. juvenil, C. globulifera, C. amorpha 1, M. trochoides 1, Gaudryina sp. 1, G. pyramidata 1 y 2; lenta: R. varians 1, D. crassa 1, Clavulinoides sp. 1) o bien, produciendo burbujas de gas que no fueron liberadas hacia la superficie (D. pupa 1, K. conversa, S. placenta 1, A. truncata 1, 2 y 3, S. spectabilis 1, M. floridana, Recurvoides sp., trochamínidos). Pasados 30 minutos desde el inicio del experimento, el grado de conservación de las conchas disminuyó
en especies como G. pyramidata 1 y 2, M. trochoides 1, D. pupa 1, Gaudryina sp. 1, C. globulifera y Clavulinoides sp. juvenil, mientras que otras especies permanecieron intactas. Pequeños fragmentos de la concha se desprendieron en G. pyramidata 1 y M. trochoides 1. También se observó la pérdida de la última cámara de D. pupa 1, y apareció un gran agujero en la parte inicial de la concha. Aproximadamente la mitad de la concha de Gaudryina sp. 1 desapareció, al igual que en C. globulifera, en la que incluso parte del relleno se disgregó. Clavulinoides sp. juvenil mostró una alta susceptibilidad a la disolución, ya que sólo algunas partes de la concha permanecieron intactas,
y la concha se desintegraba fácilmente.
Después de 2.5 horas de experimento, A. truncata 1 y 3, y K. conversa mostraron evidencias de disolución, puesto que algunos fragmentos comenzaron a desprenderse de sus conchas. Aparecieron agujeros
grandes en la última cámara y en la cara apertural de G. pyramidata 1 y M. trochoides 1, respectivamente. D. pupa 1 y Gaudryina sp. 1 también presentaron agujeros grandes, y además el grosor de sus conchas disminuyó, desintegrándose fácilmente. C. globulifera se disolvió por completo tras 2.5 horas, al igual que Clavulinoides sp. juvenil, de la cual únicamente quedó el relleno.
Pasadas 24 horas de exposición al ácido, las señales de disolución se hicieron más evidentes en algunas especies, y comenzaron
a aparecer en otras. La concha de S. spectabilis 1 parecía intacta, pero una pequeña fracción del borde lateral de la concha se rompió. D. crassa 1 y M. floridana también parecían intactas, pero se observaron algunos agujeros y se desprendieron pequeños fragmentos de sus conchas, al
igual que se observó en K. conversa. En M. trochoides 1 y G. pyramidata 1 se formaron varios agujeros, y en G. pyramidata 2 se observó el adelgazamiento de la concha. En A. truncata 1 se desarrollaron grandes agujeros en una de las paredes laterales. La concha de D. pupa 1 aumentó su fragilidad y comenzó a desintegrarse, y la concha de Gaudryina sp. 1 se disolvió totalmente quedando únicamente su relleno, mientras que el relleno de Clavulinoides sp. juvenil empezó a disgregarse.
Tras 75 horas de experimento la disolución fue más efectiva en R. varians 2 que en R. varians 1, porque en el primer caso la ornamentación ya no estaba tan marcada como al inicio y en R. varians 1 la concha permanecía intacta. Asimismo, A. truncata 2 únicamente presentó un aumento en la depresión de sus suturas, mientras que A. truncata 3 mostró agujeros en la cara apertural y su pared se adelgazó ligeramente. G. pyramidata 2 presentó adelgazamiento de su pared y varios agujeros dispersos.
Al final de la primera etapa (después de 150 horas) la concha de D. pupa 1 se deterioró aún más y el relleno de Gaudryina sp. 1 y Clavulinoides sp. juvenil se disgregó por completo. Las especies que previamente habían reaccionado a la disolución no mostraron nuevas
variaciones en el estado de conservación de sus conchas (S. spectabilis 1, K. conversa, M. floridana, D. crassa 1, M. trochoides 1, G. pyramidata 1 y A. truncata 1) y otras no fueron afectadas por la disolución (C. amorpha 1, D. cylindracea 1, R. varians 1, Clavulinoides sp. 1, H. cf. walteri 1, Ammodiscus sp., Bathysiphon sp., Glomospirella sp., Haplophragmoides sp., Hyperammina sp., K. horrida, P. proteus 1, Paratrochamminoides sp., Recurvoides sp., R. charoides, S. placenta 1 y trochamínidos).
En la segunda etapa del experimento (tras 225 horas de disolución) algunas especies permanecieron intactas como C. amorpha 1, H. cf. walteri 1, Ammodiscus sp., Bathysiphon sp., Glomospirella sp., Haplophragmoides sp., Hyperammina sp., K. horrida, P. proteus 1, Paratrochamminoides sp., Recurvoides sp., R. charoides y trochamínidos. Otras como D. crassa 1, M. floridana, K. conversa y S. spectabilis 1 no presentaron cambios en la conservación de sus conchas con respecto a la etapa anterior. Las suturas en la concha de
D. cylindracea 1 se marcaron más y la concha de S. placenta 1 comenzó a perder el brillo de su concha y presentó unos agujeros muy pequeños. El grosor de las conchas de M. trochoides 1 y Clavulinoides sp. 1 disminuyó.
Al final de la tercera etapa de disolución (375 horas de exposición al ácido) muchas especies conservaron el mismo grado de
conservación que en la etapa anterior (D. crassa 1, D. cylindracea 1, M. floridana, K. conversa y S. placenta 1); únicamente C. amorpha 1 y P. proteus 1 presentaron escasos agujeros, y las suturas más marcadas en el último ejemplar. La especie K. horrida no mostró evidencias claras de ser afectada por la disolución.
Finalmente, pasadas 5376 horas de exposición al ácido, todas las especies que no habían mostrado susceptibilidad a la disolución
en las etapas pasadas permanecieron igual (Ammodiscus sp., Bathysiphon sp., Glomospirella sp., Haplophragmoides sp., Hyperammina sp., Paratrochamminoides sp. y trochamínidos). Únicamente R. varians 1, después de haber permanecido intacta las primeras 150 horas, llegó a presentar agujeros dispersos en su concha y ésta,
a su vez, se observó ligeramente descascarillada.
Los resultados obtenidos en la segunda serie de experimentos de disolución mostraron una respuesta similar a los experimentos
de la primera serie en la mayoría de las especies (Fig. 3), aunque algunas mostraron una mayor variabilidad en su grado de susceptibilidad a la disolución. Al final de los experimentos,
las especies D. pupa y R. varians alcanzaron índices APS relativamente similares a los de la primera serie de experimentos aunque a diferentes velocidades.
La respuesta del ejemplar número 3 de R. varians es la única que se diferencia marcadamente del resto del grupo; mientras que la reacción a la disolución varía en mayor medida
entre los ejemplares de C. amorpha, G. pyramidata, M. trochoides y Clavulinoides sp., lo cual se discute en el siguiente apartado.
DiscusiónTOP
En el presente estudio se evalúa la respuesta de conchas fósiles de foraminíferos bentónicos aglutinados ante condiciones
de acidez extrema. En la Fig. 2 se observa que la mayoría de las especies que resultaron ser poco o nada susceptibles a la disolución son aquellas que sobrevivieron
al evento de extinción del Paleoceno-Eoceno, pues no presentan partículas ni cemento calcáreo (Tabla 3); mientras que los taxones que se extinguieron o que desaparecieron localmente en Zumaya presentaron una susceptibilidad
media a alta. Sin embargo, algunas especies que se extinguieron (D. cylindracea) o que desaparecieron localmente en Zumaya (ej. S. spectabilis, H. cf. walteri) muestran poca o ninguna susceptibilidad a la disolución. Si bien la pared de la mayoría de las especies aglutinadas que
se extinguieron o desaparecieron localmente estaba compuesta por cemento calcáreo y/o partículas calcáreas (Tabla 3), la disolución como única causa de las extinciones no explica la desaparición de especies con índices APS altos (con poca
susceptibilidad a la disolución). Además, la ausencia de material calcáreo en las conchas de especies que desaparecieron localmente
como H. cf. walteri y S. spectabilis, sugiere que la desestabilización de las asociaciones bentónicas no se debió únicamente a la disolución. Si bien es cierto
que se desconoce la composición de la concha de muchas especies de foraminíferos aglutinados fósiles, y que dicha composición
ha podido variar durante los procesos de fosilización (ver ejemplo en este apartado), los experimentos de disolución realizados
sugieren que los géneros Haplophragmoides y Ammodiscus no presentan partículas o cemento calcáreo, mientras que los géneros Gaudryina y Saccammina sí pueden presentar material calcáreo en su concha.
|
|
|
Por otro lado, entre los taxones afectados por la disolución hubo una diferencia notable en los tiempos de reacción. Algunas
especies como C. globulifera, Clavulinoides sp. juvenil, Gaudryina sp. (ejemplares 1–5) y D. pupa (ejemplar 1) alcanzaron índices de conservación absoluta muy bajos dentro de las primeras 2.5 horas de exposición al ácido,
mientras que el resto de los ejemplares muestran un desgaste más progresivo. Esto puede deberse al tamaño de la concha, al
grosor de la pared y/o a la cantidad de cemento de la concha. Según Nguyen et al. (2011), las especies más resistentes a la disolución son taxones grandes y de pared gruesa, lo que explicaría el hecho de que ejemplares
juveniles como Clavulinoides sp. juvenil reaccionaran rápidamente a la disolución (Fig. 2). Asimismo, la variabilidad en el grado de susceptibilidad a la disolución que muestran los ejemplares de G. pyramidata, M. trochoides y Clavulinoides sp. y C. amorpha disueltos en la segunda serie de experimentos (Fig. 3) demuestran que aquellos que son más afectados por la disolución (APS más bajos) son los que poseen los granos de su pared
más finos en comparación con el resto de los ejemplares de su misma especie, por lo que son más susceptibles a la disolución.
Ahora bien, en el caso de diferencias en la susceptibilidad a la disolución en ejemplares adultos de una misma especie, debe
tenerse en cuenta también el hecho de que el material de la concha puede haber sido reemplazado. Por ejemplo, el cemento de
R. varians es calcáreo, pero con frecuencia es silicificado durante la diagénesis (Loeblich & Tappan, 1988; Kaminski & Gradstein, 2005; Ellis & Messina, 2006), razón por la cual probablemente los ejemplares analizados de R. varians mostraron una respuesta diferente a la disolución. La concha de R. varians 3 reaccionó muy rápidamente tras 12 horas de experimento, alcanzando APS muy bajos, mientras que la de R. varians 2 fue considerablemente afectada por el ácido pasadas 24 horas, las de R. varians 4 y 5 mostraron una respuesta más gradual tras 36 horas de experimento, y por último, la concha de R. varians 1 empezó a reaccionar lentamente después de las primeras 150 horas de disolución.
La especie extinta D. cylindracea y las especies S. spectabilis y H. cf. walteri, que desaparecieron localmente en Zumaya, pertenecen al grupo de taxones que presentaron una susceptibilidad muy baja a la
disolución. D. cylindracea posee partículas calcáreas en su concha (Loeblich & Tappan, 1988), pero presenta un índice APS elevado. Se sugiere que un reemplazamiento del carbonato en la concha, o que la protección
de la misma por un recubrimiento proteínico que presenta esta especie (Loeblich & Tappan, 1988), evitaron que los ejemplares empleados en nuestros experimentos reaccionaran a la disolución, ya que dicho recubrimiento
puede ser silicificado (M. Kaminski, comunicación personal).
La reciente propuesta de que la acidificación oceánica pudo ser la principal causa de la extinción de los foraminíferos bentónicos
durante el PETM se apoya en el hecho de que los ostrácodos, aunque sí fueron afectados, no se extinguieron en este periodo
a pesar de compartir el hábitat con los foraminíferos bentónicos, probablemente debido a una mayor resistencia a la disolución
(Steineck & Thomas, 1986; Thomas, 2012). Sin embargo, los resultados del presente estudio muestran que algunas especies de foraminíferos bentónicos que presentan
elevada resistencia a la disolución, también se extinguieron (ej., D. cylindracea). Además, dicha propuesta sugiere que la saturación de calcita en el agua intersticial debió incrementar en contraste con
el agua de fondo, como resultado de la disolución del CaCO3 del sedimento, de modo que los taxones infaunales debieron estar bajo condiciones de menor estrés y por esa razón incrementó
su abundancia relativa en muchos lugares durante el PETM. Una situación análoga se encuentra en la actualidad en la Cuenca
Wagner (norte del Golfo de California, México), donde se ha registrado un descenso en el pH de las aguas, y se ha encontrado
que las asociaciones bentónicas están dominadas por grupos infaunales calcáreos (bulimínidos y nonionélidos), sin evidencias
de ser afectados por disolución (Hart et al., 2012). No obstante, los resultados del presente estudio, así como los patrones de extinción observados no sólo en Zumaya (Alegret et al., 2009a) sino también en otras secciones españolas como Alamedilla (Alegret et al., 2009b), neozelandesas como Waipawa y Tawanui (Kaiho et al., 1993), y en sondeos del Atlántico Sur (Boltovskoy & Boltovskoy, 1989) o del Océano Índico (Vincent et al., 1974) reflejan que las especies extintas, y la mayoría de las especies que muestran desapariciones locales, presentan un modo
de vida infaunal. Lo anterior refleja que la acidificación oceánica, y más concretamente las diferencias en saturación de
calcita en la interfase agua-sedimento, no debieron ser la causa única de la extinción de los foraminíferos bentónicos durante
el PETM, sino que otros factores debieron contribuir a la inestabilidad de dichas asociaciones. Dichos factores incluyen cambios
en la oxigenación y en la productividad (ver referencias en Thomas, 1998; 2007), que si bien no fueron globales, debieron influir localmente en la extinción y desaparición de los foraminíferos bentónicos.
El calentamiento de carácter global que caracteriza al PETM pudo ser otro factor clave en la perturbación de los medios oceánicos,
puesto que podría afectar el ciclo de energía dentro de los ecosistemas, afectando a la productividad de nanoplancton calcáreo
y la tasa de los procesos evolutivos, además de incrementar las tasas metabólicas, o bien modificando la composición y/o cantidad
de materia orgánica lábil disponible para la alimentación de organismos como los foraminíferos bentónicos (Thomas, 2007). En Zumaya, la suma de los procesos derivados del aumento de temperatura debió suponer un factor relevante en la extinción
de los foraminíferos bentónicos durante el PETM, puesto que el inicio de las extinciones graduales (previo al evento principal
de extinción de foraminíferos bentónicos) ocurrió bajo condiciones óxicas y sin evidencias de disolución (Alegret et al., 2009a).
ConclusionesTOP
Las especies supervivientes al evento de extinción de foraminíferos bentónicos del Eoceno inicial en el corte de Zumaya son,
en su mayoría, las que presentaron poca o nula susceptibilidad a la disolución en los experimentos realizados, y además son
las que no presentan ni cemento ni partículas de naturaleza calcárea en su concha. Sin embargo, la extinción y/o la desaparición
local de especies resistentes a la disolución, sugiere que debió haber otros factores que desestabilizaron el medio bentónico,
como cambios en la productividad y/o en la oxigenación de las aguas, un aumento en las tasas metabólicas y cambios en la composición
y cantidad del aporte alimenticio relacionados con altas temperaturas.
Por otro lado, aunque se desconoce la naturaleza del material que conforma las conchas de algunas especies de foraminíferos
bentónicos aglutinados fósiles, su respuesta a los experimentos de disolución realizados sugiere que los géneros Gaudryina y Saccammina pueden presentar partículas y/o cemento calcáreo; mientras que los géneros Haplophragmoides y Ammodiscus no tienen material calcáreo en su concha.
AGRADECIMIENTOSTOP
Agradecemos a Matías Reolid y a un revisor anónimo por sus comentarios que ayudaron a mejorar significativamente este trabajo.
Esta investigación fue financiada por el proyecto CGL2011-23077 del Ministerio de Ciencia e Innovación de España-FEDER. Arreguín-Rodríguez
agradece al Consejo Nacional de Ciencia y Tecnología de México (CONACyT) por su beca de doctorado.
ReferenciasTOP
| ○ |
Agnini, C.; Fornaciari, E.; Rio, D.; Tateo, F.; Backman, J. & Giusberti, L. (2007). Responses of calcareous nannofossil assemblages,
mineralogy and geochemistry to the environmental perturbations across the Paleocene/Eocene boundary in the Venetian pre-Alps.
Marine Micropaleontology, 63: 19–38. http://dx.doi.org/10.1016/j.marmicro.2006.10.002.
|
| ○ |
Alegret, L.; Ortiz, S.; Orue-Etxebarria, X.; Bernaola, G.; Baceta, J.I.; Monechi, S.; Apellaniz, E. & Pujalte, V. (2009a).
The Paleocene-Eocene Thermal Maximum: New data on microfossil turnover at Zumaia section, Spain. Palaios, 24: 318–328. http://dx.doi.org/10.2110/palo.2008.p08-057r.
|
| ○ |
Alegret, L.; Ortiz, S. & Molina, E. (2009b). Extinction and recovery of benthic foraminifera across the Paleocene-Eocene Thermal
Maximum at the Alamedilla section (Southern Spain). Palaeogeography, Palaeoclimatology, Palaeoecology, 279: 186–200. http://dx.doi.org/10.1016/j.palaeo.2009.05.009.
|
| ○ |
Alegret, L.; Ortiz, S.; Arenillas, I. & Molina, E. (2010). What happens when the ocean is overheated? The foraminiferal response
across the Paleocene-Eocene Thermal Maximum at Alamedilla section (Spain). Geological Society of America Bulletin, 122: 1616–1624.
http://dx.doi.org/10.1130/B30055.1.
|
| ○ |
Boltovskoy, E. & Boltovskoy, D. (1989). Paleocene-Pleistocene benthic foraminiferal evidence of major paleoceanographic events
in the eastern South Atlantic (DSDP Site 525, Walvis Ridge). Marine Micropaleontology, 14: 283–316. http://dx.doi.org/10.1016/0377-8398(89)90015-7.
|
| ○ |
Bowen, G.J.; Bralower, T.J.; Delaney, M.L.; Dickens, G.R.; Kelly, D.C.; Koch, P.L.; Kump, L.R.; Meng, J.; Sloan, L.C.; Thomas,
E.; Wing, S.L. & Zachos, J.C. (2006). The Paleocene-Eocene Thermal Maximum gives insight into greenhouse gas-induced environmental
and biotic change. Eos, 87: 165–169. http://dx.doi.org/10.1029/2006EO170002.
|
| ○ |
Bralower, T.J. (2002). Evidence of surface water oligotrophy during the Paleocene-Eocene thermal maximum: Nannofossil assemblage
data from Ocean Drilling Program Site 690, Maud Rise, Weddell Sea. Paleoceanography, 17: X1-9. http://dx.doi.org/10.1029/2001PA000662.
|
| ○ |
Charles, A.J.; Condon, D.J.; Harding, I.C.; Pälike, H.; Marshall, J.E.A.; Cui, Y.; Kump, L. & Croudace, I.W. (2011). Constraints
on the numerical age of the Paleocene-Eocene boundary. Geochemistry, Geophysics, Geosystems, 12: Q0AA17. http://dx.doi.org/10.1029/2010GC003426.
|
| ○ |
Crouch, E.M.; Heilmann-Clausen, H.; Brinkhuis, H.E.G.; Morgans, K.M.; Rogers, H.; Egger, B. & Schmitz, B. (2001). Global dinoflagellate
event associated with the Paleocene thermal maximum. Geology, 29: 315–318. http://dx.doi.org/10.1130/0091-7613(2001)029<0315:GDEAWT>2.0.CO;2.
|
| ○ |
Ellis, B.F. & Messina, A.R. (2006). Catalogue of Foraminifera. Micropaleontology Press, New York. http://www.micropress.org/em/.
|
| ○ |
Fujita, K.; Hikami, M.; Suzuki, A.; Kuroyanagi, A.; Sakai, K.; Kawahata, H. & Nojiri, Y. (2011). Effects of ocean acidification
on calcification of symbiont-bearing reef foraminifers. Biogeosciences, 8: 2089–2098. http://dx.doi.org/10.5194/bg-8-2089-2011.
|
| ○ |
Gibbs, S.J.; Bralower, T.J.; Bown, P.R.; Zachos, J.C. & Bybell, L.M. (2006). Shelf and open-ocean calcareous phytoplankton
assemblages across the Paleocene-Eocene thermal maximum: Implications for global productivity gradients. Geology, 34: 233–236.
http://dx.doi.org/10.1130/G22381.1.
|
| ○ |
Hart, M.; Pettit, L.; Wall-Palmer, D.; Smart, C.; Hall-Spencer, J.; Medina-Sanchez, A.; Prol Ledesma, R.M.; Rodolfo-Metalpa,
R. & Collins, P. (2012). Investigation of the calcification response of foraminifera and pteropods to high CO2 environments
in the Pleistocene, Paleogene and Cretaceous. Geophysical Research Abstracts, 14: EGU2012-9754.
|
| ○ |
Hintz, C.J.; Chandler, G.T.; Bernhard, J.M.; McCorkle, D.C.; Havach, S.M.; Blanks, J.K. & Shaw T.J. (2004). A physicochemically
constrained seawater culturing system for production of benthic foraminifera. Limnology and Oceanography: Methods 2: 160–170.
http://dx.doi.org/10.4319/lom.2004.2.160.
|
| ○ |
Hönisch, B.; Ridgwell, A.; Schmidt, D.N.; Thomas, E.; Gibbs, S.J.; Sluijs, A.; Zeebe, R.; Kump, L.; Martindale, R.C.; Greene,
S.E.; Kiessling, W.; Ries, J.; Zachos, J.C.; Royer, D.L.; Barker, S.; Marchitto, T.M. Jr.; Moyer, R.; Pelejero, C.; Ziveri,
P.; Foster, G.L. & Williams, B. (2012). The geological record of ocean acidification. Science, 335: 1058–1063. http://dx.doi.org/10.1126/science.1208277.
|
| ○ |
John, C.M.; Bohaty, S.M.; Zachos, J.C.; Sluijs, A.; Gibss, S.; Brinkhuis, H. & Bralower, T.J. (2008). North American continental
margin records of the Paleocene-Eocene thermal maximum: Implications for global carbon and hydrological cycling. Paleoceanography,
23: PA2217. http://dx.doi.org/10.1029/2007PA001465.
|
| ○ |
Kaiho, K.; Morgans, H.E.G. & Okada, H. (1993). Faunal turnover of intermediate-water benthic foraminifera during the Paleogene
in New Zealand. Marine Micropaleontology, 23: 51–86. http://dx.doi.org/10.1016/0377-8398(93)90053-Z.
|
| ○ |
Kaminski, M.A. & Gradstein, F.M. (2005). Atlas of Paleogene cosmopolitan deep-water agglutinated foraminifera. Grzybowski
Foundation Special Publication 10, Cracovia, Polonia, 597 pp.
|
| ○ |
Kelly, D.C.; Bralower, T.J. & Zachos, J.C. (1998). Evolutionary consequences of the latest Paleocene thermal maximum for tropical
planktonic foraminifera. Palaeogeography, Palaeoclimatology, Palaeoecology, 141: 139–161. http://dx.doi.org/10.1016/S0031-0182(98)00017-0.
|
| ○ |
Kennett, J.P. & Stott, L.D. (1991). Abrupt deep-sea warming palaeoceanographic changes and benthic extinctions at the end
of the Palaeocene. Nature, 353: 225–229. http://dx.doi.org/10.1038/353225a0.
|
| ○ |
Koch, P.L.; Zachos, J.C. & Gingerich, P.D. (1992). Correlation between isotope records in marine and continental carbon reservoirs
near the Paleocene/Eocene boundary. Nature, 358: 319–322. http://dx.doi.org/10.1038/358319a0.
|
| ○ |
Loeblich, A.R. Jr. & Tappan, H. (1988). Foraminifera genera and their classification. Van Nostrand Reinhold Company Inc.,
New York, 970 pp.
|
| ○ |
McIntyre-Wressnig, A.; Bernhard, J.M.; McCorkle, D.C. & Hallock, P. (2013). Non-lethal effects of ocean acidification on the
symbiont-bearing benthic foraminifer Amphistegina gibbosa. Marine Ecology Progress Series, 472: 45–60. http://dx.doi.org/10.3354/meps09918.
|
| ○ |
Nguyen, T.M.P.; Petrizzo, M.R. & Speijer, R.P. (2009). Experimental dissolution of a fossil foraminiferal assemblage (Paleocene-Eocene
Thermal Maximum, Dababiya, Egypt): Implications for paleoenvironmental reconstructions. Marine Micropaleontology, 73: 241–258.
http://dx.doi.org/10.1016/j.marmicro.2009.10.005.
|
| ○ |
Nguyen, T.M.P.; Petrizzo, M.R.; Stassen, P. & Speijer, R.P. (2011). Dissolution susceptibility of Paleocene-Eocene planktic
foraminifera: Implications for palaeoceanographic reconstructions. Marine Micropaleontology, 81: 1–21. http://dx.doi.org/10.1016/j.marmicro.2011.07.001.
|
| ○ |
Orue-Etxebarria, X.; Pujalte, V.; Bernaola, G.; Apellaniz, E.; Baceta, J.I.; Payros, A.; Núñez-Betelu, K.; Serra-Kiel, J.
& Tosquella, J. (2001). Did the Late Paleocene Thermal Maximum affect the evolution of larger foraminifers?: Evidences from
calcareous plankton of the Campo section (Pyrenees, Spain). Marine Micropaleontology, 41: 45–71. http://dx.doi.org/10.1016/S0377-8398(00)00052-9.
|
| ○ |
Pujalte, V.; Orue-Etxebarria, X.; Schmitz, B.; Tosquella, J.; Baceta, J.I.; Payros, A.; Bernaola, G.; Caballero, F. & Apellaniz,
E. (2003). Basal Ilerdian (earliest Eocene) turnover of larger foraminifera: age constraints based on calcareous plankton
and δ13C isotopic profiles from new southern Pyrenean sections (Spain). En: Causes and consequences of Globally Warm Climates
in the Early Paleogene (Wing, S.L.; Gingerich, P.D.; Schmitz, B. & Thomas, E., Eds.), Geological Society of America Special
Paper, 369: 205–221. http://dx.doi.org/10.1130/0-8137-2369-8.205.
|
| ○ |
Reymond, C.E.; Lloyd, A.; Kline, D.I.; Dove, S.G. & Pandolfi, J.M. (2013). Decline in growth of foraminifer Marginopora rossi
under eutrophication and ocean acidification scenarios. Global Change Biology, 19: 291–302. http://dx.doi.org/10.1111/gcb.12035.
|
| ○ |
Ries, J.B.; Cohen, A.L. & McCorkle, D.C. (2009). Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification. Geology, 37: 1131–1134. http://dx.doi.org/10.1130/G30210A.1.
|
| ○ |
Röhl, U.; Bralower, T.J.; Norris, R.D. & Wefer, G. (2000). New chronology for the late Paleocene thermal maximum and its environmental
implications. Geology, 28: 927–930. http://dx.doi.org/10.1130/0091-7613(2000)28<927:NCFTLP>2.0.CO;2.
|
| ○ |
Setoyama, E.; Radmacher, W.; Kaminski, M.A. & Tyszka, J. (2013). Foraminiferal and palynological biostratigraphy and biofacies
from a Santonian-Campanian submarine fan system in the Vøring Basin (offshore Norway). Marine and Petroleum Geology, 43:
396–408. http://dx.doi.org/10.1016/j.marpetgeo.2012.12.007.
|
| ○ |
Steineck, P.L. & Thomas, E. (1986). The latest Paleocene crisis in the deep sea: Ostracode succesion at Maud Rise, Southern
Ocean. Geology, 24: 583–586. http://dx.doi.org/10.1130/0091-7613(1996)024<0583:TLPCIT>2.3.CO;2.
|
| ○ |
Stoll, H.M. (2005). Limited range of interspecific vital effects in coccolith stable isotopic records during the Paleocene-Eocene
thermal maximum. Paleoceanography, 20: PA1007. http://dx.doi.org/10.1029/2004PA001046.
|
| ○ |
Takeda, K. & Kaiho, K. (2007). Faunal turnovers in central Pacific benthic foraminifera during the Paleocene-Eocene thermal
maximum. Palaeogeography, Palaeoclimatology, Palaeoecology, 251: 175–197. http://dx.doi.org/10.1016/j.palaeo.2007.02.026.
|
| ○ |
Thomas, E. (1998). The biogeography of the late Paleocene benthic foraminiferal extinction. En: Late Paleocene-early Eocene
biotic and climatic events in the marine and terrestrial records (Aubry, M.-P.; Lucas, S.G. & Berggren, W.A., Eds.), New York,
Columbia University Press, 214–243.
|
| ○ |
Thomas, E. (2007). Cenozoic mass extinctions in the deep sea: what disturbs the largest habitat on Earth?. En: Large ecosystems
perturbations: causes and consequences (Monechi, S.; Coccioni, R. & Rampino, M., Eds.), Geological Society of America Special
Paper, 424: 1–24. http://dx.doi.org/10.1130/2007.2424(01).
|
| ○ |
Thomas, E. (2012). Agglutinated benthic foraminifera during ocean acidification: what holds them together? En: Ninth International
Workshop on Agglutinated Foraminifera (Alegret, L.; Ortiz, S. & Kaminski, M.A., Eds.), Abstract volume, 95–97.
|
| ○ |
Tjalsma, R.C. & Lohman, G.P. (1983). Paleocene-Eocene bathyal and abyssal benthic foraminifera from the Atlantic Ocean. Micropaleontology
Special Publication 4, 89 pp.
|
| ○ |
Vincent, E.; Gibson, J.M. & Brun, L. (1974). Paleocene and Early Eocene microfacies, benthonic foraminifera, and paleobathymetry
of Deep Sea Drilling Project Sites 236 and 237, western Indian ocean. En: Initial Reports of the Deep Sea Drilling Project
(Fisher, R.L.; Bunce, E.T.; et al., Eds.), Washington (U. S. Government Printing Office), 24: 859–885.
|
| ○ |
Wing, S.L.; Harrington, G.J.; Smith, F.A.; Bloch, J.I.; Boyer, D.M. & Freeman, K.H., (2005). Transient floral change and
rapid global warming at the Paleocene-Eocene boundary. Science, 310: 993–996. http://dx.doi.org/10.1126/science.1116913.
|
| ○ |
Zachos, J.C.; Pagani, M.; Sloan, L.; Thomas, E. & Billups, K. (2001). Trends, rhythms, and aberrations in global climate 65
Ma to present. Science, 292: 686–693. http://dx.doi.org/10.1126/science.1059412.
|
| ○ |
Zachos, J.C.; Wara, M.W.; Bohaty, S.; Delaney, M.L.; Petrizzo, M.R.; Brill, A.; Bralower, T.J. & Premoli-Silva, I. (2003).
A transient rise in tropical sea surface temperature during the Paleocene-Eocene Thermal Maximum. Science, 302: 1551–1554.
http://dx.doi.org/10.1126/science.1090110.
|
| ○ |
Zachos, J.C.; Röhl, U.; Schellenberg, S.A.; Sluijs, A.; Hodell, D.A.; Kelly, D.C.; Thomas, E.; Nicolo, M.; Raffi, I.; Lourens,
L.J.; McCarren, H. & Kroon, D. (2005). Rapid Acidification of the Ocean During the Paleocene-Eocene Thermal Maximum. Science,
308: 1611–1615. http://dx.doi.org/10.1126/science.1109004.
|
Fig. 1.—Imágenes SEM de algunos ejemplares de foraminíferos bentónicos de Zumaya e índice APS alcanzado tras los experimentos de
disolución. Escala =100 μm. 1) Gaudryina pyramidata 2, vista frontal, muestra Zu -280, APS 4. 2) G. pyramidata 1, vista apertural, muestra Zu -200, APS 4. 3) Marssonella trochoides 1, vista apertural, muestra Zu 10-17, APS 5. 4) Arenobulimina truncata 3, vista frontal, muestra Zu 10-17, APS 6-5. 5) A. truncata 1, vista frontal, muestra Zu -200, APS 5. 6) Clavulinoides amorpha 1, vista frontal, muestra Zu 10-17, APS 6. 7) Clavulinoides sp. 1, vista frontal, muestra Zu 30-40, APS 6. 8) Remesella varians 2, vista frontal, muestra Zu -280, APS 6. 9) A. truncata 2, vista frontal, muestra Zu -200, APS 7-6. 10) Dorothia crassa 1, vista frontal, muestra Zu 0-6, APS 7-6. 11) M. floridana, vista frontal, muestra Zu 0-6, APS 7-6. 12) Karrerulina conversa, vista frontal, muestra Zu -200, APS 7. 13) D. cylindracea 1, vista frontal, muestra Zu 0-6, APS 7. 14) Paratrochamminoides proteus 1, vista frontal, muestra Zu 0-6, APS 7. 15) Saccammina placenta 1, vista frontal, muestra Zu -200, APS 7. 16) K. horrida, vista frontal, muestra Zu -200, APS 8. 17) Recurvoides sp., vista frontal, muestra Zu -200, APS 8. 18) Repmanina charoides, vista en sección, muestra Zu -200, APS 8. 19) Spiroplectammina spectabilis 1, vista frontal, muestra Zu 0-6, APS 8-7, el ejemplar se rompió durante la manipulación y no a causa de la disolución. 20)
Haplophragmoides cf. walteri, vista frontal, muestra Zu -50, APS 8.